
Die Else Kröner-Fresenius-Stiftung (EKFS) unterstützt im Rahmen der Else Kröner Memorialstipendien klinisch und wissenschaftlich tätige Ärztinnen und Ärzte am Beginn ihres Berufsweges. Durch eine zweijährige Freistellung von klinischen Aufgaben haben die Stipendiatinnen und Stipendiaten die Möglichkeit, sich auf ein erfolgversprechendes medizinisches Forschungsvorhaben zu konzentrieren. Das Stipendium ist mit insgesamt 250.000 € dotiert.
In diesem Jahr erhalten neun Medizinerinnen und Mediziner ein Else Kröner Memorialstipendium:

Dr. Maximilian Y. Deng, Klinik für Radioonkologie und Strahlentherapie Universitätsklinikum Heidelberg
Projekt: Tumor Monitoring und molekulare Risikostratifikation mittels Liquid Biopsy bei Meningeompatienten vor Radiotherapie
Die Radiotherapie stellt einen effektiven Behandlungsansatz in der Therapie des Meningeoms dar, eines Hirntumors, der aus der Hirnhaut entsteht. Diese Therapie wird insbesondere bei inoperablen Patientinnen und Patienten bevorzugt. Aufgrund von möglichen Operationsrisiken werden oftmals Biopsien bei chirurgisch schwierig zugänglichen Tumoren vermieden, so dass durch das Fehlen von Tumormaterial eine der Tumoraggressivität angepasste Bestrahlungsplanung nicht möglich ist. Das Projekt zielt darauf ab, die im Blut frei-zirkulierenden Moleküle, sogenannte Exosomen, als möglichen Biomarker im Sinne einer Liquid Biopsy für das Therapieansprechen und bei der Früherkennung von Rezidiven zu etablieren. Zudem wird das molekulare Profil der Exosomen untersucht, die einen Rückschluss auf die Tumorbiologie und Aggressivität des Meningeoms ermöglichen soll, die im therapeutischen Management (z. B. Nachsorgeintervalle) berücksichtigt werden können.

Dr. Jan Kempski, I. Medizinische Klinik und Poliklinik, Universitätsklinikum Hamburg-Eppendorf
Projekt: Identifizierung von immunologischen Merkmalen, welche die Reaktion auf Immuntherapien beeinflussen
Die Wechselwirkung zwischen dem Immunsystem und Krebszellen ist weiterhin nicht ausreichend geklärt. Mit dem Aufkommen neuer Immuntherapien wird das Verständnis dieser Interaktion immer wichtiger. Immuntherapien können mit entzündlichen Reaktionen einhergehen, welche Autoimmunerkrankungen ähneln und oftmals die Behandlung einschränken. In diesem Projekt wird untersucht, wie sich Signale des Immunsystems auf die Wirksamkeit von Immuntherapien auswirken und welche Faktoren zu einer Darmentzündung unter diesen Therapien führen. Insbesondere wird das Zusammenspiel von Darmbakterien und Immunzellen untersucht. Ziel des Projektes ist es, Merkmale zu identifizieren, welche das Ansprechen auf Immuntherapien und das Auftreten von entzündlichen Nebenwirkungen vorhersagen können.

Dr. Dr. Emre Kocakavuk, Klinik für Hämatologie und Stammzelltransplantation, Westdeutsches Tumorzentrum, Universitätsmedizin Essen
Projekt: KI-gestützte Charakterisierung von Copy-number-Signaturen im Kontext von Krebstherapien
Neben Mutationen beeinflussen auch Kopienzahlvarianten bzw. Copy Number Variations (CNVs) den Ausbruch, das Fortschreiten und die Therapieresistenz von Krebs. Dr. Dr. Emre Kocakavuk und sein Team werden CNV-Signaturen bei wiederkehrenden und metastasierenden Krebserkrankungen nach der Behandlung umfassend untersuchen. Diese Signaturen werden mit klinischen Behandlungsdaten verknüpft. Es sollen klinisch-genomische Datensätze genutzt und fortschrittliche KI- und maschinelle Lernalgorithmen angewendet werden, um den Weg für die Entwicklung genombasierter Ansätze in die personalisierte Onkologie zu ebnen.

Dr. Julia Lang-Meli, Klinik für Innere Medizin II, Universitätsklinik Freiburg
Projekt: Geschlechterspezifische Unterschiede in der CD8+ T Zell-vermittelten Immunkontrolle der chronischen Hepatitis B-Virusinfektion
Bei der chronischen Hepatitis B-Virusinfektion (HBV) ist bekannt, dass Männer eine höhere Viruslast im Blut aufweisen und häufiger Komplikationen wie Leberkrebs bekommen. Die zugrundeliegenden Mechanismen sind jedoch bisher unbekannt. Tierexperimentelle Daten und eigene Vorarbeiten weisen auf eine mögliche wichtige Rolle HBV-spezifischer T-Killer-Zellen hin. In dem Forschungsvorhaben sollen nun die immunologischen Mechanismen aufgedeckt werden, die zu einem unterschiedlichen klinischen Verlauf der chronischen HBV-Infektion bei Männern und Frauen führen. Konkret ist bei Frauen und Männern ein Screening auf die Zusammensetzung HBV-spezifischer Immunzellen und die Definition von Phänotyp und Funktion der spezifischen T-Killer-Zellen u. a. mittels Durchflusszytometrie und scRNAseq vorgesehen.
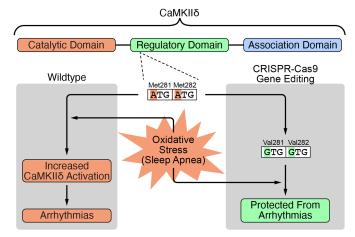
PD Dr. Simon Lebek, Klinik und Poliklinik für Innere Medizin II Universitätsklinikum Regensburg
Projekt: CRISPR-Cas9 Geneditierung der CaMKIIδ als antiarrhythmische Therapie bei schlafbezogenen Atemstörungen
Schlafbezogene Atemstörungen (SBAS) gehen häufig mit Herzrhythmusstörungen einher und reduzieren so die Lebensqualität und -erwartung, weshalb neue und verbesserte Behandlungsstrategien dringend benötigt werden. Kürzlich konnten PD Dr. Simon Lebek und sein Team zeigen, dass es bei Patientinnen und Patienten mit SBAS zu einer gesteigerten Aktivierung eines bestimmten Krankheitsfaktors (CaMKIIδ) kommt, was zu Herzrhythmusstörungen führt. Ziel ist es, die Aktivierungsstelle dieses schädlichen Krankheitsfaktors auszuschalten, um eine neue Behandlungsstrategie zu entwickeln. Dies soll sowohl in menschlichen Herzmuskelzellen als auch in lebenden Mäusen mit SBAS getestet und optimiert werden. Langfristig könnte dieser Ansatz zu einem neuen Medikament für Herzrhythmusstörungen bei Patientinnen und Patienten mit SBAS führen.

Dr. Caroline Perner, Klinik für Hämatologie, Hämostaseologie, Onkologie und Stammzelltransplantation, Medizinische Hochschule Hannover
Projekt: Definition immunzellabhängiger und -unabhängiger physiologischer Veränderungen in sensorischen Nervenzellen im Alterungsprozess
Sensorische Nervenzellen sind nicht nur für Sinneswahrnehmungen zuständig, sondern regulieren über die Ausschüttung von Neuropeptiden und Neurotransmittern auch aktiv Immun- und Gewebeprozesse. Dabei spielen sie eine entscheidende Rolle in der Bekämpfung von Krankheitserregern, bei allergischen Prozessen und beeinflussen Wundheilung und Regeneration. Dieses Projekt zielt darauf ab, altersbedingte Veränderungen der Reizerkennung und -reaktion in sensorischen Neuronen zu charakterisieren und zu entschlüsseln, ob Immunzellen eine aktive Rolle bei der Progression dieses Prozesses einnehmen. Die hier gewonnenen Erkenntnisse sollen helfen, die Ursachen für das gestörte Gleichgewicht von Gewebe und Immunsystem im Alter besser zu verstehen und einen Ansatzpunkt für die Entwicklung von Therapien für ein gesünderes Altern zu schaffen.

Dr. Saskia Räuber, Klinik für Neurologie, Universitätsklinikum Düsseldorf, Heinrich-Heine-Universität Düsseldorf
Projekt: Analyse der Immunmechanismen von paraneoplastischen neurologischen Syndromen
Das Immunsystem versucht stetig der Entstehung und Ausbreitung von Krebszellen und damit der Entstehung sowie dem Fortschreiten von Tumoren entgegenzuwirken. Diese erwünschte Immunantwort kann allerdings auch fehlgeleitet werden und neurologische Symptome hervorrufen. Solche als paraneoplastische neurologische Syndrome (PNS) bezeichnete Erkrankungen können verschiedene Bereiche des Nervensystems betreffen. Mittels moderner immunologischer Methoden möchte Dr. Saskia Räuber mit ihrem Team ein tieferes Verständnis der PNS und grundlegende Erkenntnisse über das Verhalten des Immunsystems bei Krebserkrankungen erlangen. Neben der frühzeitigen Diagnose und Therapie der PNS soll somit auch ein relevanter Beitrag zur Diagnose und Therapie der Krebserkrankungen im Frühstadium geleistet werden.
Dr. Marie-Christin Weber, Klinikum rechts der Isar, Klinik und Poliklinik für Chirurgie, Fakultät für Medizin, Technische Universität München
Projekt: Prävention von intestinalen Anastomoseninsuffizienzen durch Stimulation der serosalen Wundheilung und Induktion der mesothelial-mesenchymalen Transition von Mesothelzelle
Eine intakte intestinale Wundheilung ist der Schlüssel zu einer erfolgreichen chirurgischen Therapie bei Darmkrebs. Insbesondere die Heilung der Nähte, die die beiden Darmenden nach der Tumorresektion wieder miteinander verbinden, ist entscheidend. Jedoch ist die Rate der Leckagen im Bereich dieser Nähte (Anastomoseninsuffizienzen) nach wie vor hoch, was zu hoher Morbidität und Mortalität führt. Mit dem vorliegenden Projekt sollen die zellulären Prozesse während der Anastomosenheilung detailliert untersucht werden. Der Schwerpunkt liegt dabei auf der Untersuchung der Rolle der serosalen Darmwandschicht und der dort ansässigen Zellen, den Mesothelzellen, bei der Anastomosenheilung und ihrem potenziellen Nutzen für gezielte Behandlungen zur Prävention von Anastomoseninsuffizienzen.

Dr. Marcel Seungsu Woo, Institut für Neuroimmunologie und Multiple Sklerose (INIMS), Universitätsklinikum Hamburg-Eppendorf (UKE)
Projekt: Das Interferon Netzwerk in der inflammatorischen Neurodegeneration
Die Multiple Sklerose (MS) ist eine entzündliche Erkrankung des zentralen Nervensystems und die häufigste Ursache für nicht-traumatische neurologisch bedingte Behinderung im jungen Erwachsenenalter. In der MS führt eine chronische Entzündung im Gehirn und Rückenmark zu einem kontinuierlichen Verlust von Nervenzellen, welcher nicht effektiv durch Therapien behandelt werden kann. Daher sind neue Therapieansätze notwendig, um die Nervenzellen direkt zu schützen. In diesem Projekt werden verschiedene molekulare Methoden kombiniert, um die Mechanismen der entzündungsbedingten Neurodegeneration, also der Prozesse, die zu einem Funktionsverlust der Nervenzellen führen, zu entschlüsseln. Insbesondere soll die Rolle des Botenstoffs Interferon für die Neurodegeneration untersucht werden und dadurch neue Therapieansätze entwickelt werden.